2017年3月6日,根据国家食品药品监督管理总局药品审评中心(CDE)2月28日发布的公告,歌礼丙肝新药丹诺瑞韦被纳入优先审评程序。这是继2016年4月公司另一个丙肝新药瑞维达韦被纳入优先审评程序后歌礼产品再次被纳入。
CDE公告显示,此次共有丹诺瑞韦等24个药品注册申请纳入优先审评程序,其中丙肝类产品共有3家企业的4个品种被纳入,仅有丹诺瑞韦为新药上市申请(NDA),其余均为新药临床试验申请(IND)。
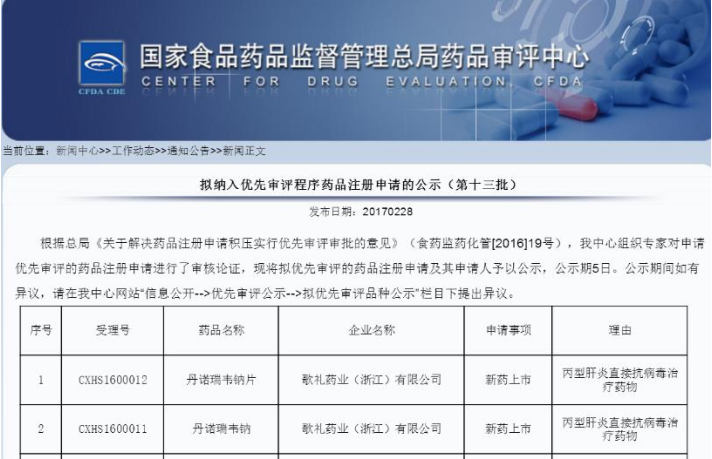
丹诺瑞韦是歌礼自主研发的小分子直接抗病毒药物,属第二代蛋白酶抑制剂,已获十三五国家“重大新药创制”科技重大专项支持。截至目前,丹诺瑞韦已累计在国内外完成37个临床I、II、III期试验,受试者超过2600人。不久前在亚太肝病学会上海年会期间发布的最新临床试验数据显示,丹诺瑞韦联合PR三联方案对初治的非肝硬化的中国基因1型慢性丙型肝炎患者治愈率达(SVR12)达96%。
歌礼于2016年12月递交丹诺瑞韦上市申请并通过浙江省食品药品监督管理局全面核查,获得CDE受理。