- 经肝穿活检证实的代谢功能障碍相关脂肪性肝炎(MASH)患者接受ASC41治疗12周后,肝脏脂肪含量较基线的相对降幅平均值高达68.2%
- ASC41在MASH患者中展示出肝脏脂肪、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)和血脂显著降低且具有临床意义,且安全性和耐受性数据良好
中国杭州,2024年6月11日--歌礼制药有限公司(香港联交所代码:1672,“歌礼”)旗下致力于代谢功能障碍相关脂肪性肝炎(MASH)领域新药研究开发和商业化的全资子公司甘莱制药有限公司(“甘莱”)今日宣布在欧洲肝脏研究学会(EASL)2024年大会做了壁报展示,该大会于2024年6月5日至8日在意大利米兰举办。壁报详见甘莱官网www.gannexpharma.com的壁报/发布页面。
题为《ASC41,一种选择性THRβ激动剂,12周治疗后显著降低经活检证实的MASH患者的肝脏脂肪和丙氨酸氨基转移酶:一项为期52周的肝脏活检连续研究的期中分析》的壁报展示了在接受ASC41片治疗12周的活检证实MASH患者中,肝脏脂肪、丙氨酸氨基转移酶(ALT)和天冬氨酸氨基转移酶(AST)具有临床意义的显著降低,其中ALT和AST的数据使得ASC41明显区别于目前处于临床或商业化阶段的其它甲状腺激素受体β(THRβ)激动剂。此外,ASC41(在中国开展的)与resmetirom的II期临床试验基线特征相似,但ASC41的体重指数(BMI)更低且男性更多。有关更多详细信息,请参阅下方的表1。
表1. 基线特征

[1] Harrison, S. A., et al.[J] Lancet, (2019).DOI: 10.1016/s0140-6736(19)32517-6.
表1中,“ALT”代表丙氨酸氨基轉移酶,“AST”代表天冬氨酸氨基轉移酶,“HDL-C”代表高密度脂蛋白胆固醇,“LDL-C”代表低密度脂蛋白胆固醇,“TG”代表甘油三酯。
ASC41,一种每日一次的口服片剂,是一种肝脏靶向小分子,具有高度THRβ选择性。该口服片剂由歌礼内部专有制剂技术开发。三项I期或Ib期研究已在中国完成,受试者为低密度脂蛋白胆固醇(LDL-C)>110 mg/dL的健康或肥胖受试者。美国的一项I期研究表明,ASC41/ASC41-A与最常用的抗抑郁药物和他汀类药物之间无具有临床意义的药物相互作用,美国人和中国人在相同剂量下的药物暴露量也无明显差异。
表2. 第12周肝脏脂肪含量、肝酶和血脂生物标志物较基线的变化
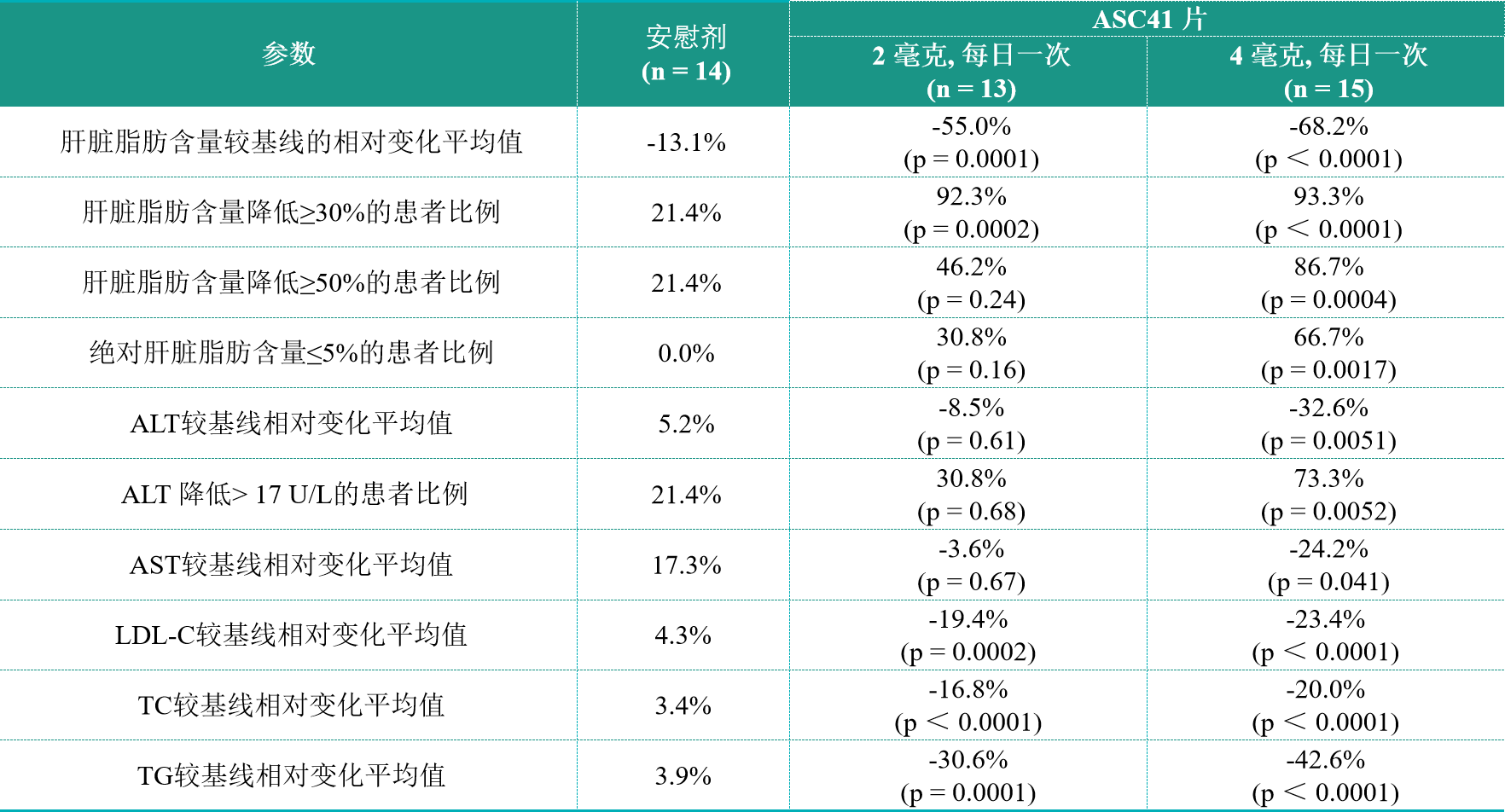
表2中,“ALT”代表丙氨酸氨基轉移酶,“AST”代表天冬氨酸氨基轉移酶、“LDL-C”代表低密度脂蛋白胆固醇,“TC”代表总胆固醇,“TG”代表甘油三酯。
“经磁共振质子密度脂肪分数(MRI-PDFF)评估,93.3%接受ASC41片剂治疗的患者肝脏脂肪含量较基线相对降低30%及以上,我们认为这是纤维化减少的有力预测指标。”歌礼创始人、董事长兼首席执行官吴劲梓博士表示,“对评估肝损伤和肝功能失常非常重要的肝脏炎症生物标志物ALT和AST、LDL-C、总胆固醇(TC)和甘油三酯(TG)的降低,可降低心血管相关事件的风险,再加上良好的安全性和耐受性,令我们相信ASC41是一种潜在的同类最佳THRβ激动剂。我们期待着推进ASC41的临床开发。”
ASC41的耐受性普遍良好,在该项II期临床试验中,包括安慰剂队列在内的所有队列的不良事件(AE)大多为1级(见表3)。接受ASC41治疗或安慰剂治疗的患者均未报告与治疗相关的严重不良事件(SAE)。与之前的研究一样,ASC41表现出极佳的胃肠道(GI)耐受性。
表3. 安全性数据
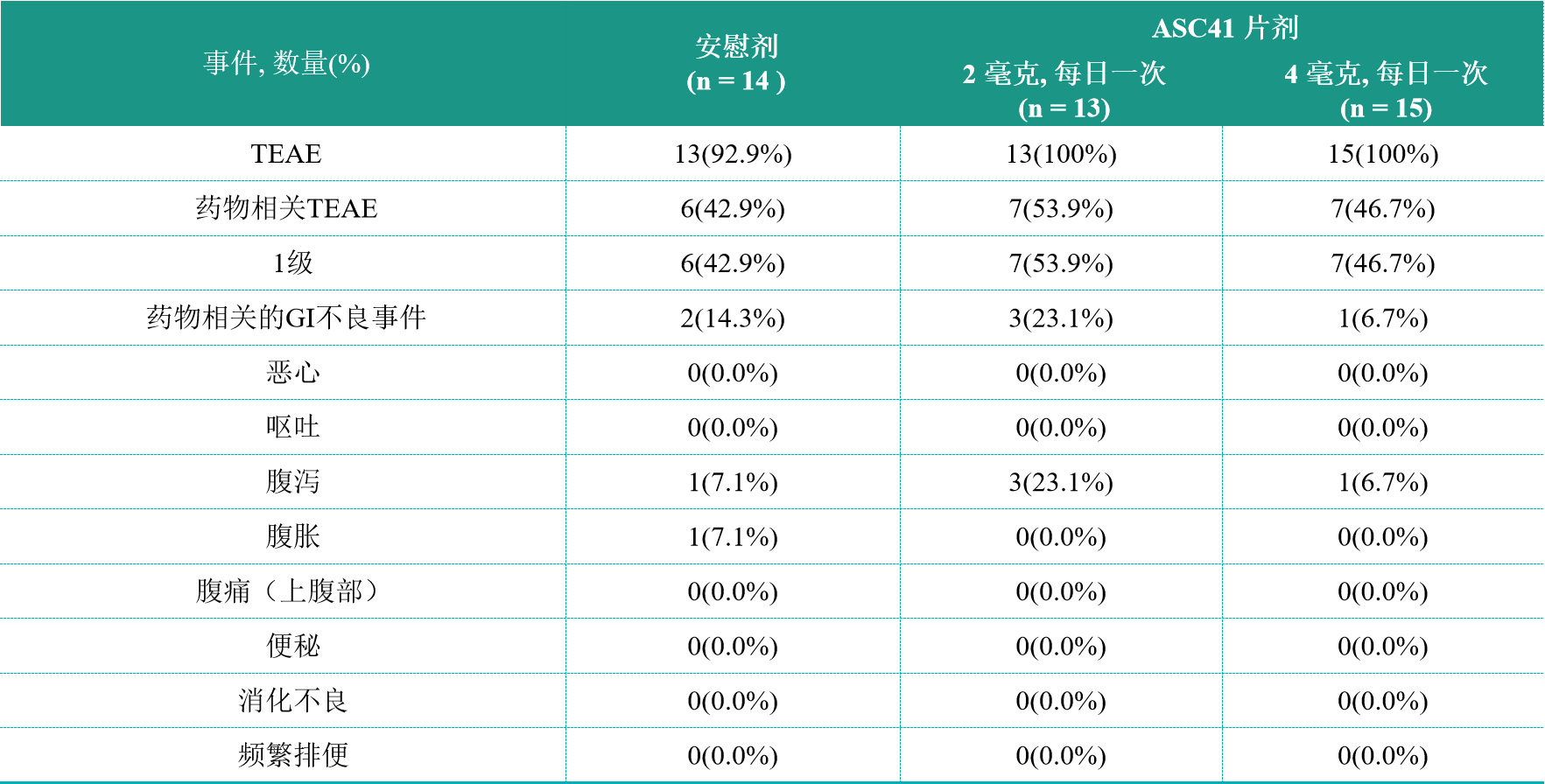
表3中,“TEAE”代表治疗期出现的不良事件,“GI”代表胃肠道。
关于ASC41
ASC41是用于治疗MASH的每日一次口服片剂,目前正处于临床开发阶段。ASC41是一种肝脏靶向小分子,可转化为活性代谢物ASC41-A,ASC41-A是一种强效、高选择性的THRβ激动剂。ASC41片剂由歌礼内部专有制剂技术开发。ASC41片剂制剂专利已在美国获得授权。
关于该II期临床试验
该项随机、双盲、安慰剂对照及多中心的II期临床试验(ClinicalTrials.gov: NCT05462353)正在中国开展,预计入组约180名经肝穿活检证实的MASH患者,以1:1:1的比例随机分配进入两个ASC41片治疗队列(2毫克或4毫克),一日一次,和一个安慰剂对照队列,治疗52周并随访4周。入组包括经MRI-PDFF评估基线肝脏脂肪含量为7.5%及以上的,以及肝脏纤维化为F2和F3的患者。该研究允许入组至多15%的肝脏纤维化为F1的患者。在基线和52周治疗结束时将分别进行一次肝穿活检。在基线、第12周和第52周将分别进行MRI-PDFF评估。预设的期中分析在42名入组患者完成为期12周的ASC41片或安慰剂治疗后进行。主要目标为因坏死性炎症(炎症或气球样变)减轻促使的组织学非酒精性脂肪性肝病(NAFLD)活动评分(NAS)降低≥2分且纤维化无恶化。次要目标包括MASH缓解和纤维化改善。
关于歌礼
歌礼是一家在香港证券交易所上市(1672.HK)的创新研发驱动型生物科技公司,涵盖了从新药研发至GMP生产的完整价值链。歌礼的管理团队具备深厚的专业知识及优秀的过往成就,在团队的带领下,歌礼聚焦三大临床需求尚未满足的医疗领域:病毒性疾病、代谢功能障碍相关脂肪性肝炎和肿瘤,并以全球化的视野进行布局。凭借卓越的执行力,歌礼快速推进药物管线开发,争取在国际竞争中占据领先地位。歌礼目前拥有多款临床开发阶段的在研药物, 最前沿的候选药物包括ASC22(乙肝功能性治愈)、ASC40(痤疮)、ASC40(复发性胶质母细胞瘤)、ASC40(代谢功能障碍相关脂肪性肝炎)、ASC41(代谢功能障碍相关脂肪性肝炎)及ASC61(晚期实体瘤)。
欲了解更多信息,敬请登录网站:www.ascletis.com。
详情垂询:
歌礼制药有限公司
+86-181-0650-9129
pr@ascletis.com
关于甘莱
甘莱成立于2019年,是歌礼旗下一家处于临床阶段的全资子公司,致力于MASH领域新药的研发和商业化。甘莱拥有两款处于临床阶段的候选药物,分别针对两个不同的靶点,即THRβ(ASC41)和脂肪酸合成酶(FASN) (ASC40)。
欲了解更多信息,敬请登录网站:www.gannexpharma.com。
详情垂询:
甘莱制药有限公司
Peter Vozzo
ICR Westwicke
443-231-0505 (美国)